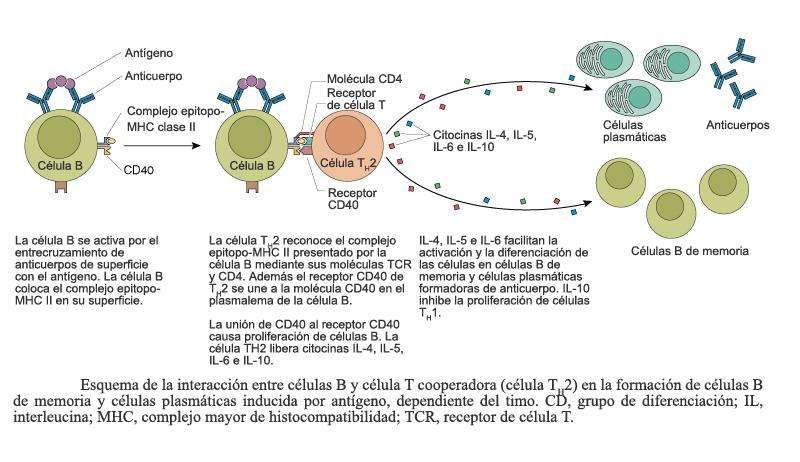
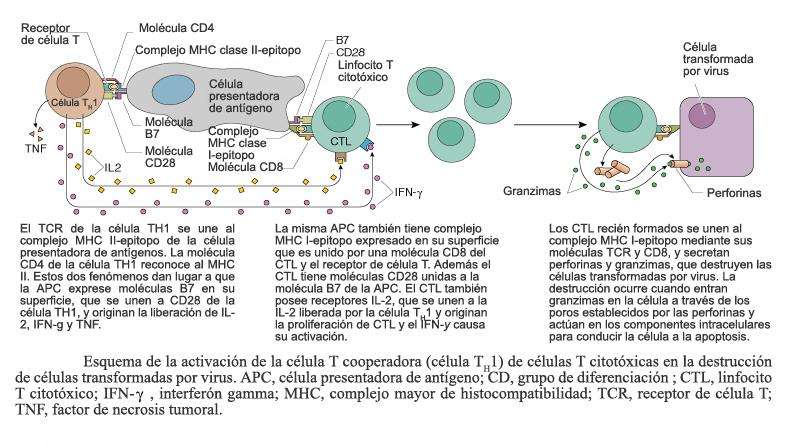
________________________________________________
Capitulos dificles, pero con cuidado se entienden...Continuacion Cap 08________________________________________________
Moléculas de adhesión celular. Selectinas Las selectinas son receptores de adhesión que se caracterizan por poseer una estructura muy conservada, la cual incluye a un dominio tipo lectina, un dominio tipo factor de crecimiento epidérmico, dos o más dominios tipo proteína reguladora del complemento, una región transmembranal y una región intracitoplásmica corta en el extremo carboxilo terminal (Figura 8.2).

Se han identificado a tres miembros de esta familia, los cuales corresponden a los antígenos de diferenciación leucocitaria CD62L (L-selectina), CD62P (P-selectina) y CD62E (E-selectina); estas tres moléculas reconocen y se unen, a través de su dominio tipo lectina, a diversos oligosacáridos, los cuales están usualmente conjugados con proteínas transmembranales. Los carbohidratos que parecen interaccionar más fuertemente con las selectinas corresponden a las formas sializadas y fucosiladas del tetrasacárido Lewis x (sLex) y su isómero, Lewis a (sLea) (Figura 8.3).

Según se describe posteriormente, las moléculas que interaccionan con las selectinas poseen, en mayor o menor grado, este tipo de carbohidratos (Tabla 8.1.)

La selectina L (CD62L) se expresa constitutivamente en la membrana de granulocitos, monocitos y la mayoría de los linfocitos de sangre venosa periférica; al activarse estas células, la mayor parte de la selectina L es eliminada de la membrana mediante un mecanismo enzimático, el cual genera una forma soluble de la molécula, que es liberada al medio extracelular. La selectina P (CD62P) se expresa constitutivamente pero es almacenada en gránulos intracitoplásmicos de plaquetas y células endoteliales; al activarse estas células la selectina P es translocada a la membrana plasmática, permitiendo la interacción con sus ligandos. Por último, la selectina E (CD62E) no se expresa de novo en células endoteliales, como consecuencia de la inducción de la expresión del gen correspondiente durante la activación celular; esta inducción es generalmente consecuencia del efecto de lipopolisacáridos bacterianos o de citocinas tales como interleucina‑1 o factor de necrosis tumoral‑alfa.
Mucinas como ligandos de las selectinasHasta el momento se han identificado con precisión a cuatro moléculas que interaccionan de forma específica con las diferentes selectinas, GlyCAM‑1 (Glycosylated‑dependent Cell Adhesion Molecule‑1), CD34, MadCAM‑1 (Mucosal addressin Cell Adhesion molecule‑1) y PSGL‑1 (P Selectin Glycoprotein Ligand-1). Estas moléculas pueden ser incluídas dentro de la familia de las mucinas ya que poseen una estructura extendida y están ricamente glicosiladas en residuos de serina y treonina (sitios de O‑glicosilación). GlyCAM‑1 se expresa preferencialmente en las células endoteliales cuboidales de las vénulas (HEV o High Endothelial Venules) de los ganglios linfáticos; esta molécula no posee una región transmembranal propiamente dicha y es posible que una proporción significativa de la misma sea secretada al medio extracelular. La molécula CD34 es un antígeno de diferenciación leucocitaria que se detecta en células hematopoyéticas inmaduras y células endoteliales; a diferencia de GlyCAM‑1, la expresión de CD34 en endotelios no es restringida y se detecta tanto en células endoteliales planas como en cuboidales de diversos órganos y tejidos. Sin embargo, la función de CD34 como ligando de la selectina L depende de su adecuada glicosilación y sulfatación.
La molécula MadCAM‑1 posee una región tipo mucina y tres dominios tipo inmunoglobulina, por lo que puede ser incluída también en la superfamilia de las Ig. MadCAM‑1 se expresa en el endotelio cuboidal de los vasos sanguíneos de las placas de Peyer del intestino delgado y una variante de la misma (la cual es detectada con un anticuerpo denominado MECA 70) se detecta en las células endoteliales de los ganglios linfáticos mesentéricos. GlyCAM‑1, CD34 y MadCAM‑1 interaccionan en forma específica con la selectina L; como se expondrá posteriormente, MadCAM‑1 interacciona también con la integrina alfa-4/beta-7. La molécula PSGL‑1 se detecta principalmente en granulocitos y otras células mieloides; este receptor de adhesión corresponde a una molécula transmembranal homodimérica que parece interaccionar con gran afinidad con la selectina P.
Se han identificado otros ligandos de selectinas. La molécula CLA (Cutaneous Lymphocyte Antigen) se expresa en una subpoblación de linfocitos y posee carbohidratos semejantes a la forma sializada de Lex, los cuales conforman un determinante antigénico que es detectado con el anticuerpo denominado HECA‑452; esta molécula interacciona con la selectina E y se detecta en forma preferencial en algunos linfocitos T de memoria. Además, recientemente se ha identificado una proteína (ESL-1, E-selectin ligand) en células mieloides con homología al factor de crecimiento de fibroblastos que actúa como un ligando adicional para la selectina-E. El posible papel de otras moléculas que parecen interaccionar con selectinas (por ejemplo. fragmentos de heparina o algunos glicoesfingolípidos) en la migración de leucocitos, deberá de dilucidarse a través de estudios futuros.
Integrinas. La familia de las integrinas comprende a un grupo amplio de moléculas heterodiméricas constituídas por dos subunidades polipéptidicas transmembranales denominadas cadenas alfa y beta (Figura 8.4).

Las diferentes subfamilias de integrinas se forman de acuerdo a la cadena beta que poseen, la cual puede asociarse en una forma restringida con diferentes cadenas alfa. Hasta el momento se han identificado a 16 cadenas alfa y 8 cadenas beta, las cuales dan lugar a 21 integrinas diferentes ( Figura 8.5).

La subfamilias que tienen un papel importante en los fenómenos de migración leucocitaria corresponden a las integrinas beta-1 (Tabla 8.2), beta-2 (Tabla 8.3), beta-3 (Tabla 8.4) y beta-7 (Tabla 8.5).




Una proporción importante de las cadenas alfa y beta de integrinas corresponden a antígenos de diferenciación leucocitaria, pero usualmente solo las integrinas beta-2 son con frecuencia designadas con la nomenclatura correspondiente a esos antígenos (beta2=CD18, alfaL=CD11a, alfaM=CD11b y alfaX=CD11c).
La integrinas beta-1 se expresan en la mayor parte de las células del organismo, con la notable excepción de los granulocitos; de éstos, solamente los eosinófilos expresan el heterodímero alfa-4/beta-1, en tanto que en los basófilos y los neutrófilos es indetectable la presencia de estas integrinas. Por otra parte, los linfocitos expresan diversas integrinas beta-1 y algunas de éstas incrementan significativamente su expresión días después de que estas células se han activado; por esta razón, estas moléculas se han denominado también como antígenos de activación tardía de linfocitos o moléculas VLA (Very Late Activation antigens). Las integrinas beta-2 se denominan también integrinas leucocitarias debido a que se expresan preferencialmente en células mieloides (granulocitos y monocitos); sin embargo, la molécula LFA‑1 (alfaL/beta2) se expresa tanto en células mieloides como linfoides. Por último, los 2 miembros de la subfamilia de las integrinas beta-7, los heterodímeros alfa4/beta7 y alfaE/beta7 se expresan principalmente en linfocitos que se localizan preferencialmente en las placas de Peyer, lámina propia y el epitelio intestinal.
Las cadenas a de la integrinas corresponden a glicoproteínas cuyo peso molecular (120‑180 kD) es mayor que el de las cadenas beta (90‑110 kD), a las cuales están asociadas en forma no covalente. En su extremo amino terminal, estas cadenas a poseen 7 u 8 regiones homólogas (dominios tipo integrina), de las cuales 3 ó 4 pueden unir cationes divalentes (Ca2+, Mg2+, Mn2+). Como se expondrá posteriormente, la presencia de estos cationes ejerce un papel clave en la función adherente de las integrinas. Las cadenas beta son glicoproteínas transmembranales que poseen regiones muy conservadas en la porción extracelular, las cuales parecen formar parte del sitio de interacción con el ligando. Estas cadenas también poseen regiones ricas en cisteina, a partir de las cuales se forman puentes disulfuro intracatenarios, uno de ellos con la región amino terminal de la cadena polipeptídica. El sitio de combinación con el ligando está formado por regiones de las dos cadenas polipeptídicas, aunque es conveniente mencionar, que la especificidad de la interacción con el ligando está determinada principalmente por la cadena alfa.
Ligandos de las integrinas
Las integrinas beta1 interaccionan principalmente con componentes de la matriz extracelular (colágeno, laminina, fibronectina) (Tabla 8.1); estas diferentes integrinas pueden interaccionar con el mismo ligando (por ejemplo. colágeno ó fibronectina), reconociendo el mismo sitio (por ejemplo., la secuencia de aminoácidos Arg‑Gly‑Asp o RGD es reconocida tanto por alfa3/beta1 como por alfa5/beta1) o con sitios diferentes (el heterodímero alfa2/beta1 reconoce la secuencia Asp‑Gly‑Glu‑Ala o DGEA en el colágeno tipo I). La integrina alfa4/beta1 o VLA‑4 interacciona también con un receptor de adhesión de la familia de las Ig, la molécula VCAM‑1, que es expresada principalmente por células endoteliales activadas. Por otra parte, las integrinas leucocitarias o beta-2 interaccionan principalmente con las moléculas de adhesión intercelular (ICAMs), factores de complemento y fibrinógeno; en particular, el heterodímero alfaL/beta2 (LFA‑1) interacciona con ICAM‑1, ‑2 y ‑3, en tanto que alfaM/beta2 (Mac‑1, CR3), lo hace solo con ICAM‑1. La recién identificada integrina alfaD/beta2 interacciona preferentemente con ICAM-3. Hasta el momento no se ha encontrado que alfaX/beta2 (CR4) interaccione con alguna de las moléculas de adhesión intercelular. Por otra parte, la integrina alfa4/beta7 interacciona con baja afinidad con VCAM‑1 y también con MadCAM‑1. En estudios recientes, se ha descrito que tanto alfa4/beta7, como alfa4/beta1 son capaces de interaccionar con cadenas alfa4 aisladas, sugiriendo que estas moléculas pueden interaccionar entre sí mismas.
Las integrinas tienen la capacidad de modificar en forma rápida y reversible su avidez por su o sus ligandos. Esta capacidad está relacionada con dos fenómenos, cambio en la conformación de la integrina que incrementa su afinidad por el ligando y agrupamiento de las integrinas en un sitio determinado de la membrana celular, lo que permite interacciones ligando‑receptor múltiples y estables. Esta transición reversible en la avidez permite que una célula pueda interaccionar de forma dinámica con otras células o con componentes de la matriz extracelular, lo cual es importante en los fenómenos de migración celular. Esta característica funcional de las integrinas contrasta con la de otras moléculas de adhesión celular; por ejemplo., las cadherinas en condiciones fisiológicas poseen una avidez alta y constante por su ligando, lo cual tiene como consecuencia que las interacciones celulares mediadas por éstas sean en general estáticas y no relacionadas con motilidad celular.
Integrinas y afinidad celularLa afinidad de las integrinas puede ser regulada por factores fisiológicos y no fisiológicos. Entre los primeros, el fenómeno principal que se ha relacionado con el incremento en la afinidad de las integrinas es la activación celular; así, los diversos factores que intervienen en la activación leucocitaria (antígenos, productos bacterianos, citocinas, etc.) inducen indirectamente el cambio en la conformación de integrinas y el incremento en su afinidad por el ligando. El mecanismo molecular íntimo que induce la activación de las integrinas está aún por dilucidarse. Por otra parte, el cambio en la localización topográfica de las integrinas en la membrana celular, que influye en forma importante en la fuerza de interacción de estas moléculas con su ligando, parece ser consecuencia principalmente de modificaciones en el citoesqueleto, lo cual ocurre también como resultado de señales intracelulares generadas durante la activación celular. Así, la fuerza de interación de las integrinas con sus ligandos depende principalmente de dos factores, el estado conformacional del heterodímero y su densidad y localización topográfica en la membrana celular; a su vez, estos dos factores están en íntima relación con el fenómeno de activación celular (Figura 8. 6).

Como se mencionó anteriormente, la presencia de cationes divalentes influye notablemente sobre el estado conformacional de las integrinas. Se ha encontrado que la presencia de Ca2+ inhibe la activación de estas moléculas, en tanto que el Mg2+ y el Mn2+ la favorecen. De hecho, el Mn2+ a concentraciones altas (que no es hasta el momento claro que se consigan normalmente in vivo) es capaz por sí mismo de inducir la activación de integrinas beta-1.
Integrinas y transmisión de señalesLas integrinas poseen una región intracitoplásmica relativamente corta que por si misma no genera señales de activación. Sin embargo, es evidente que la interacción de las integrinas con sus ligandos resulta en la generación de señales que son de importancia en la activación, diferenciación y proliferación celular. Lo anterior se explica por el hecho de que la porción intracelular de las integrinas está asociada con diversos componentes del citoesqueleto. Las integrinas muestran una localización preferencial en ciertas regiones de la membrana denominadas complejos de adhesión focal; en estos sitios, la porción intracelular de las integrinas se asocian con las proteinas talina y actinina‑alfa, las cuales a su vez interaccionan con otros componentes del citoesqueleto tales como vinculina, paxilina, tensina y actina (Figura 8.7).

A estos complejos de adhesión focal se asocian también diversas proteínas intracelulares involucradas en la generación de señales de activación tales como la cinasa de adhesiones focales o FAK (Focal Adhesion Kinase), proteina‑tirosina cinasas (Src, Csk), cinasas de serina/treonina (PKC o proteina cinasas C), cinasas de fosfolípidos (PI‑3K, PIP‑5 cinasa) y posiblemente GTPasas de bajo peso molecular (Ras, Rho). La activación de estas enzimas induce a su vez la activación de otras enzimas (fosfolipasa C, MAP cinasa), lo que finalmente resulta en fenómenos tales como la reorganización del citoesqueleto o la inducción de la expresión de diversos genes. Es necesario mencionar aquí que las señales intracelulares generadas a través de las integrinas pueden tener un efecto sinérgico con las inducidas a través de otros receptores celulares y que en conjunto resultan finalmente en activación, proliferación y diferenciación celular. Por tanto, las integrinas participan activamente no solo en fenómenos de adhesión celular sino que también están involucradas en otra serie de fenómenos clave en la fisiología celular. De lo anterior, se puede concluir que las integrinas efectivamente sirven como una vía de integración (de ahí su nombre) entre el medio intra y extracelular.
Superfamilia de las inmunoglobulinas. Algunos miembros de la superfamilia de las Ig (ICAM‑1, ICAM‑2, VCAM‑1 y PECAM) están implicados en fenómenos de adhesión de leucocitos a células endoteliales y su subsiguiente migración. El receptor de adhesión ICAM‑1 interviene además en fenómenos de co‑estimulación de células inmunes y de adhesión entre leucocitos y entre éstos y células diana (fenómenos de citotoxicidad). Otros miembros de la superfamilia de las Ig tienen también un papel importante en la adhesión inter‑leucocitaria, generación de señales de co‑estimulación (por ej. ICAM‑3, CD2, etc.) en la interrelación de las células presentadoras de antígenos y los linfociots, pero no participan de forma importante en la migración leucocitaria (Figura 8.8 y Tabla 8.6 ).

 Moléculas de adhesión intercelular (ICAMs)
Moléculas de adhesión intercelular (ICAMs)Las moléculas de adhesión intercelular (ICAMs) involucradas en la interacción leucocito‑endotelio corresponden a glicoproteinas que poseen dos (ICAM‑2) o cinco (ICAM‑1) dominios tipo inmunoglobulina, una región transmembranal y una porción intracitoplásmica corta. Los dos dominios más extracelulares son lo que determinan la interacción de ICAM‑1 y ‑2 con la integrina leucocitaria LFA‑1 (alfaL/beta2), en tanto que la interacción de ICAM‑1 con el heterodímero alfaM/beta2 parece estar mediada por el tercer dominio de esta molécula. La porción intracelular de las moléculas de adhesión intercelular posee residuos de serina, treonina y tirosina, los cuales son fosforilados durante la activación celular. Al igual que en el caso de las integrinas, los ICAMs están asociadas al citoesqueleto y participan, al interaccionar con su ligando, en la generación de señales intracelulares de activación.
Receptor de adhesión ICAM‑1 (CD54). Este receptor se puede detectar en diversas células del organismo (leucocitos, queratinocitos, células endoteliales, etc.). En condiciones basales, la mayor parte de éstas células muestran una expresión débil o nula de ICAM‑1, pero bajo condiciones de activación celular, tanto células leucocitarias como endoteliales presentan una fuerte expresión de esta molécula.
Receptor de adhesión ICAM‑2 (CD102). En contraste con lo anterior, ICAM‑2 (CD102) muestra un patrón de expresión más restringido (células endoteliales, algunos leucocitos, plaquetas) y su nivel de expresión no se modifica con la activación celular. Se ha encontrado que LFA‑1 interacciona con mayor afinidad con ICAM‑1 que con ICAM‑2, por lo que aún bajo condiciones de baja expresión, ICAM‑1 podría tener un papel relevante en determinados procesos fisiológicos.
Molécula VCAM‑1 (CD106). Esta molécula se expresa en la membrana de células endoteliales activadas. Se han detectado diversas formas de la molécula, con 6, 7 y 8 dominios tipo Ig, e incluso una con solo 3 y asociada a la membrana a través de una unión tipo glicosilfosfatidilinositol (GPI). Todas estas formas interaccionan con la integrina alfa4/beta1, aunque no con la misma afinidad. Como ya se ha mencionado, VCAM‑1 interacciona también con el heterodímero alfa4/beta7, pero esta interacción parece ser de menor afinidad y no es claro que ocurra con todas las diferentes isoformas de VCAM‑1.
Receptor de adhesión PECAM‑1 (CD31). Este receptor posee seis dominios tipo Ig y se expresa en leucocitos, plaquetas y células endoteliales. Las moléculas de CD31 de una célula interaccionan con las expresadas por otras células (interacción CD31:CD31 o interacción homofílica) y al parecer también con la integrina alfav/beta3, atribuyéndosele a dicha interacción un posible papel en procesos de angiogénesis. En las células endoteliales CD31 tiende a localizarse en los sitios de contacto célula‑célula y se piensa que puede intervenir en el control de la permeabilidad vascular y la migración transendotelial de leucocitos. La interacción de CD31 con sus ligandos parece dar lugar a la generación de señales intracelulares importantes en la activación de integrinas beta1 y beta2.
Otras moléculas de adhesión.
Molécula CD44. Esta molécula corresponde a un proteoglicano que se expresa en diversas células del organismo. Se han detectado múltiples isoformas de CD44 y al menos 5 de éstas se expresan en leucocitos. CD44 interacciona con ácido hialurónico, así como con colágeno, laminina y fibronectina. Existen datos que indican que la avidez de CD44 por sus ligandos es también variable y que esta molécula pudiese tener un papel importante en la migración de leucocitos del torrente sanguíneo hacia sitios de inflamación; también es posible que CD44 participe en la recirculación de células linfoides en condiciones fisiológicas. Por último existe información que sugiere que las moléculas de CD44 expresadas por células endoteliales poseen la capacidad de captar factores quimiotácticos (principalmente quimiocinas) los cuales activarían a los leucocitos que estuviesen interaccionando con células endoteliales.
Receptor de adhesión VAP‑1 (Vascular Adhesion Protein‑1). Esta molécula e expresa preferencialmente en el endotelio cuboidal de las vénulas de órganos linfoides, con la excepción del tejido linfoide asociado al intestino. En los sitios con infiltrado inflamatorio crónico (por ejemplo. en la membrana sinovial de la artritis reumatoide), se forman también vasos sanguíneos con endotelio cuboidal, los cuales igualmente expresan VAP‑1. Aunque el ligando de VAP‑1 no se conoce, la distribución anatómica de esta molécula sugiere que está involucrada en la recirculación de linfocitos a tejidos linfoides y sitios con inflamación crónica.
Molécula denominada L‑VAP‑2 (Lymphocyte‑Vascular Adhesion Protein‑2). Esta moléculaha sido solo parcialmente caracterizada y corresponde a una proteína de 70 kDa que se expresa en algunas vénulas de diversos tejidos, linfoides y no linfoides. L‑VAP‑2 se expresa también en algunos linfocitos B y T CD8+ y parece mediar la adhesión entre éstas células y endotelio.
__________________________________________________