_________________________________________________
Respuestas 8-9-10-11
__________________________________________________
Problema 8: neutralizando una disolución ácida
¿Cuántos mililitros se requieren de una disolución de NaOH 0,2 M para llevar a 7 el pH de 20 ml de una disolución de HCl 0,4 M?
A. 4
B. 40
C. 10
D. 20
E. 5
RESPUESTA CORRECTA:
B. 40
Como el ácido tiene el doble de concentración que la base, el pH neutro se alcanza añadiendo un volumen de disolución básica que duplique al de la ácida.
Tutoría
Neutralizando una disolución ácida
Este problema es similar al anterior. No requiere de ningún cálculo complicado, simplemente se resuelve considerando cómo funcionan los ácidos y las bases.
Para empezar, tanto el NaOH como el HCl se disocian completamente en agua, por tanto no hacen falta cálculos con valores de pKa. En consecuencia, una cantidad dada de una disolución ácida tiene el mismo número de protones libres que iones hidroxilo hay en la misma cantidad de una disolución básica de igual concentración.
En este caso, la concentración de la disolución ácida (0,4 M) es el doble que la de la disolución básica (0,2 M). De esta manera, el pH neutro se obtiene añadiendo el doble de la cantidad de disolución básica al ácido.
________________________________________________
Problema 9: ácidos y pKa
Los ácidos se definen como compuestos con valores de pKa por debajo de 7,0.
A. Verdadero
B. Falso
RESPUESTA CORRECTA:
B. Falso
Los ácidos se definen como compuestos que ceden protones en disolución
Tutoría
Ácidos
Los ácidos se definen como compuestos que ceden protones en disolución. El pH para el cual la mitad de las moléculas de un ácido han cedido su protón es su pKa. Los ácidos fuertes como el HCl ceden protones incluso a pH muy bajo (por tanto tienen un pKa bajo) y los ácidos débiles sólo ceden protones si el pH es muy alto (es decir, a muy baja concentración de protones libres). El pH al que ocurre esto puede estar fácilmente por encima de 7.
Un ejemplo importante de esto es la tirosina, cuyo grupo R es fenólico; un grupo ácido con un pKa ~ 10.
Al contrario, las bases pueden tener pKa < 7,0.
¿Puedes pensar en una base biológicamennte importante con un pKa menor que 7,0?
Respuesta = Histidina
La mayoría de los ácidos biológicos, sin embargo, son ácidos más débiles que el HCl. La principal clase de ácidos biológicos son los ácidos carboxílicos. Como la diferencia de electronegatividad entre el oxígeno y el hidrógeno de un ácido carboxílico no es tan acusada como en el HCl, la tendencia de un ácido carboxílico a ceder su protón es mucho menor que la del HCl. Sin embargo, los ácidos carboxílicos se disocian más rápidamente que el agua debido a la presencia de dos oxígenos electronegativos.
La tendencia de un ácido a disociarse están en función de la fuerza del ácido y del pH de la disolución. Los ácidos fuertes se disocian incluso cuando el pH es bajo, pero esto no ocurre con los ácidos débiles.
Por conveniencia, se identifica el pH al cual el ácido está disociado al 50% (la mitad protonado y la otra mitad desprotonado). Este valor de pH se define como el pKa del ácido en cuestión. Por ejemplo:
CH3COOH (ácido acético) ---> CH3COO- (ión acetato) + H+ ; pKa = 4,8;
lo que significa que a pH = 4,8, la mitad de las partículas están ionizadas (acetato) y la otra mitad no lo están (ácido acético). Cuanto más fuerte sea un ácido, más bajo será su pKa.
Bases
Al contrario que los ácidos, las bases son capaces de captar protones en un medio acuoso y por tanto estarán cargadas positivamente en su forma protonada, y no tendrán carga en la desprotonada. La base débil biológica más común es el grupo amino (R-NH2).
A pesar de las diferencias entre ácidos y bases, el pKa también se puede utilizar para cuantificar la fuerza relativa de las bases. Nota que mientras que los valores de pKa para los ácidos son generalmente menores que 7, los valores de pKa para las bases son usualmente mayores que 7. Por ejemplo, la etanolamina tiene un pKa de 9,5 y está protonada al 50% (carga media = +1/2) cuando el pH es 9,5 (Figura 4). Una importante excepción a esta regla es el aminoácido histidina, que es una base pero tiene un pKa alrededor de 6,0
________________________________________________________
Problema 10: relación entre pKa y pH
La relación correcta entre pKa y pH es que:
A. Ambos son funciones logarítmicas.
B. Ambos son siempre < 7 para ácidos y > 7 para bases.
C. Estos dos conceptos no están relacionados de ninguna manera puesto que los fluidos
biológicos contienen mezclas de demasiados ácidos y bases.
D. Cuando pH = pKa, el compuesto en cuestión tendrá carga de +0,5.
E. Cuando pH = pKa, el compuesto ionizable en cuestión (ya sea ácido o base) estará la mitad protonado y la mitad desprotonado.
RESPUESTA CORRECTA:
E. Cuando pH = pKa, el compuesto ionizable en cuestión (ya sea ácido o base) estará la mitad protonado y la mitad desprotonado.
De hecho, esta es la definición exacta de pKa.
Tutoría
pKa y pH La relación entre pKa y pH está representada matemáticamente por la ecuación de Henderson-Hasselbalch:
pH = pKa + log [A-] / [HA]
donde [A-] representa la forma desprotonada y [HA] representa la forma protonada.
Una solución habitual de esta ecuación se obtiene al asignar arbitrariamente que pH = pKa.
En este caso,
log([A-] / [HA]) = 0, y [A-] / [HA] = 1.
En otras palabras, esto significa que cuando el pH es igual al pKa del ácido, hay igual cantidad de las formas protonada y desprotonada de la molécula. Esta misma relación vale para las bases, con [B] sustituyendo a [A-] como la forma desprotonada y [HB+] sustituyendo a [HA] como la forma protonada. Se debe tener en cuenta que la relación de Henderson-Hasselbach es válida para un ácido o base específico incluso si están presentes diversos ácidos o bases.
En la siguiente figura (y para el ácido acético), se muestran otras soluciones para la ecuación de Henderson-Hasselbalch en un intervalo de valores de pH.
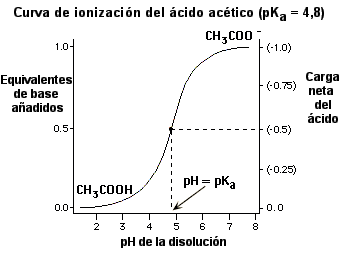
La "carga neta del ácido" se refiere al promedio de todas las moléculas de ácido en la disolución.
Hay varios aspectos en esta gráfica que merecen un comentario:
* En el pKa, el ácido está desprotonado en un 50%.
* A una unidad de pH por encima (por debajo) del pKa, el ácido está desprotonado (protonado) en un 90%.
* A dos unidades de pH por encima (por debajo) del pKa, el ácido está desprotonado (protonado) en un 99%.
* A tres unidades de pH por encima (por debajo) del pKa, el ácido está desprotonado (protonado) en un 99,9%.
* Cuando está totalmente protonado, la carga del ácido acético es 0.
* Cuando está totalmente desprotonado, la carga del acetato es -1.
___________________________________________________________________
Problema 11: pH y capacidad tamponante de una mezcla
Si se mezclan volúmenes iguales de NaH2PO4 0,05 M y H3PO4 0,05 M,
¿cuál de las siguientes opciones describe mejor la disolución resultante?
(Los pKa para el ácido fosfórico son 2,0, 6,8 y 12,0)
A. pH 2 y pobre tamponamiento.
B. pH 2 y buen tamponamiento.
C. pH 6,8 y buen tamponamiento.
D. pH 12 y buen tamponamiento.
E. pH 6,8 y pobre tamponamiento
RESPUESTA CORRECTA:
B. pH 2 y buen tamponamiento.
Cantidades iguales de ácido fosfórico (H3PO4) y dihidrógeno fosfato de sodio (NaH2PO4) darán un pH de 2,0, que es el primer pKa del ácido fosfórico.
Como los dos componentes de la mezcla están a 50 mM y la disolución está en el equilibrio del pKa de la primera ionización, la disolución podrá neutralizar hasta 25 mM de ácido o de base antes de que se agote su capacidad tamponante.
Se considera, así, que la disolución tiene buena capacidad de tamponamiento.
Tutoría
Reconocimiento adecuado de las formas protonadas y desprotonadas de un ácido con varias ionizaciones.
El ácido fosfórico puede seguir tres ionizaciones, por lo tanto tiene tres valores de pKa (dados como 2,0, 6,8 y 12,0 en el problema). El ácido fosfórico como grupo fosfato tiene gran importancia biológica debido a su papel en DNA/RNA, en moléculas energéticas como el ATP, en la fosforilación de proteínas, etc.; merece la pena, por ello, dedicar un tiempo a examinar esas reacciones de ionización.
Imagina la forma inicial totalmente protonada. Intuitivamente, esta protonación total debería ocurrir cuando la [H+] es muy alta, es decir, a bajo pH. Así, a pH 1, o menos, más del 90% del ácido fosfórico está como H3PO4.
Ahora imagina que se añade NaOH a una disolución de H3PO4 a pH 1. Los iones OH- se combinan con los H+ para dar agua, lo que eleva el pH y deja Na+ en la disolución. Cuando el pH se va acercando a 2,0, ¿qué ocurre con el H3PO4? Puesto que 2,0 es el primer pKa, se empezará a liberar el primer protón. Esto tiene dos consecuencias, una concierne a la forma química del H3PO4 y la otra al tamponamiento.
La forma química del H3PO4
En lo concerniente a la forma química del H3PO4, una vez que el primer H+ se ha liberado totalmente (lo que ocurre cuando el pH está por encima de 3), lo que tenemos es H2PO4-. Pero como en esta reacción también se libera Na+ (al combinarse el OH- y el H+ para producir agua), podemos poner que los iones en la disolución están como Na+H2PO4-, o simplemente NaH2PO4 (dihidrógeno fosfato de sodio).
Así, esta primera ionización se escribe como sigue:
NaOH + H3PO4 ---> H2O + NaH2PO4 ; pKa = 2,0
¿Cuál es la reacción de la segunda ionización?
La reacción para la segunda ionización es:
NaOH + NaH2PO4 ---> H2O + Na2HPO4
¿Cuál es la reacción de la tercera ionización?
La reación para la tercera ionización es:
NaOH + Na2HPO4 ---> H2O + Na3PO4
Tamponamiento
Como para la parte anterior, sólo necesitamos darnos cuenta de que durante la transición entre el pH 1,0 y el 3,0 la mayoría de los H+ que se utilizan para combinarse con el OH- proceden del H3PO4. Los protones no vienen del agua pero la relación [H+] x [OH-] = 10 - 14 aún se mantiene; por tanto, el pH no cambia mucho cuando se añade NaOH en la transición de pH 1 a 3. Este no es el caso entre, por ejemplo, los pH 3,0 y 5,8, cuando la adición de NaOH no toma H+ del fosfato, puesto que no hay valor de pKa para la disociación del fosfato en este intervalo (el segundo pKa corresponde a 6,8 ). Así, los protones deben proceder del agua y el pH cambia bruscamente en este intervalo.
El concepto de tamponamiento se puede mostrar gráficamente, como se ve debajo.

En el pKa o cerca de él, tanto los ácidos como las bases débiles amortiguan las variaciones de pH, actuando así como tampones.
Como se ha descrito antes, esto se debe a su afinidad por los protones, que son las especies iónicas que determinan el pH.
De esta manera, una disolución amortiguará los cambios de pH cerca de su valor de pKa (ver el área sombreada en la figura superior).
En este problema, la disolución de ácido fosfórico amortiguará los cambios de pH cuando se añade NaOH hasta que casi todo el H3PO4 haya pasado a la forma H2PO4-.
A valores de pH >> pKa, la afinidad del ácido fosfórico por los protones no es suficiente para unir H+ hasta que no se alcance el siguiente valor de pKa, y a valores de pH << pKa, prácticamente todo el ácido fosfórico ha unido ya H+ y no está disponible para unir más H+ adicionales.
Por tanto, el ácido fosfórico, como cualquier otro ácido o base débil, sólo es efectivo como tampón a valores de pH de una unidad por encima o por debajo de su pKa .
___________________________________________________________
Fin del facsimil
Sencillamente muy bueno !!
____________________________________________________________