___________________________________________________
___________________________________________________
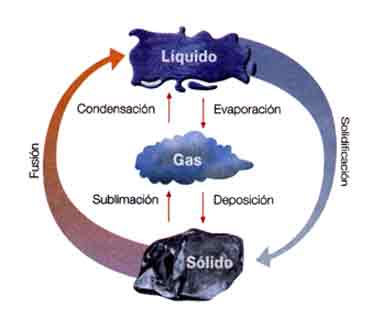
ESTADOS DE LA MATERIA
1. Estado sólido
Un sólido es una sustancia formada por moléculas que se encuentran estrechamente unidas entre sí mediante una fuerza llamada fuerza de cohesión, las particulas están muy unidas, y solo vibran en su puesto .
La disposición de estas moléculas le da un aspecto de dureza y de rigidez con el que frecuentemente se le asocia.
La forma definida de los sólidos es producto de la fuerza de cohesión que mantiene unidas a las moléculas.
Los sólidos son duros y presentan dificultad para comprimirse. Esto se explica porque las moléculas que los forman están tan cerca, que no dejan espacios entre sí. Si miras a tu alrededor, notarás que todos los sólidos tienen una forma definida. Esta característica se mantiene, salvo que actúe sobre ellos una fuerza tan grande que los deforme.
Los Sólidos > Tienen dificultad para comprimirse > Tienen forma definida
Los sólidos pueden identificarse por estas dos propiedades generales. Si agrupas sobre una mesa un elástico, un vidrio, plasticína, una piedra, un plato y una cuchara, podrás decir que todos ellos son sólidos; sin embargo, cada uno de ellos es diferente del otro. Ahora la observación te permitirá hacer una clasificación.
Clasificar significa agrupar identificando las propiedades que sirven de base para ello, de acuerdo a un criterio establecido previamente.
¿A qué se debe que los sólidos sean diferentes?
Estas diferencias pueden explicarse debido a que los cuerpos sólidos presentan propiedades específicas, en mayor o menor grado, entre las cuales señalaremos:
* Elasticidad: Un sólido recupera su forma original cuando es deformado. Un elástico o un resorte son objetos en los que podemos observar esta propiedad. Estira un elástico y observa lo que sucede.
* Fragilidad: Un sólido puede romperse en muchos pedazos (quebradizo). En más de una ocasión habrás quebrado un vaso de vidrio o un objeto de greda. Estos hechos representan la fragilidad de un sólido.
*Dureza: Un sólido es duro cuando no puede ser rayado por otro más blando. El diamante de una joya valiosa o el utilizado par cortar vidrios presenta dicha propiedad
2. Estado líquido
Un líquido es una sustancia formada por moléculas que están en constante movimiento de desplazamiento y que se deslizan unas sobre las otras.
La disposición de estas moléculas le da un aspecto de fluidez con la que frecuentemente se les asocia.
¿A qué se debe que los líquidos cambien de forma?
Si aplicas fuerza sobre la superficie del agua de una cubeta, observarás que ésta pierde su aspecto inmóvil y que puedes distinguir su movimiento a través de la formación de ondas en la superficie.
Los líquidos son fluidos porque no tienen forma propia, sino que adoptan la forma del recipiente que los contiene. Por ejemplo, si echas igual cantidad de un líquido en un tubo de ensayo, a un plato o en una botella, éstos adoptarán la forma de cada uno de estos objetos. Si observas algunos líquidos notarás que ninguno de ellos tiene forma definida y que, al igual que los sólidos, tampoco pueden comprimirse. Si intentas comprimir el agua de la cubeta notarás que se escurre hacia los lados, pero que no disminuye su volumen.
¿A qué se debe el cambio de forma que pueden presentar los líquidos?
La forma indefinida de los líquidos se debe a que la fuerza de atracción que mantiene unidas las moléculas es menos intensa que la fuerza que mantiene unidas las moléculas de los sólidos.
Alguna vez habrás jugado a echarle agua a una jeringa y habrás empujado el émbolo. ¿Qué has observado?
¿Por qué los líquidos son incompresibles?
Los líquidos son incompresibles porque las moléculas que los constituyen están tan unidas que no pueden acercarse más; sólo pueden deslizarse las unas sobre las otras.
Los Líquidos > Tienen forma indefinida > Son incompresibles
Los líquidos, al igual que los sólidos, presentan propiedades específicas entre las cuales señalaremos:
* Volatilidad, es decir, facilidad para evaporarse. Esta propiedad se aprecia claramente al dejar abierto un frasco con alcohol, en que se percibe su olor y disminuye el volumen.
* Viscosidad, es decir, dificultad al escurrimiento. ¿Has dado vuelta alguna vez una botella de aceite o, tal vez, has echado aceite al motor de un vehículo? ¿Observas lo mismo al derramar un vaso .con agua? La diferencia en la observación se debe a la viscosidad.
Estas propiedades se presentan en mayor o menor grado en todos los líquidos.
Los perfumes, la bencina y la parafina son líquidos volátiles. La miel y la leche condensada son líquidos viscosos.
3. Estado gaseoso
Un gas es una sustancia formada por moléculas que se encuentran separadas entre sí.
Esta disposición molecular le permite tener movilidad, por lo que no posee forma propia y puede comprimirse. En él la fuerza de cohesión es nula y ha sido remplazada por la fuerza de repulsión entre las moléculas.¿Por qué los gases no poseen forma propia?
Los gases no poseen forma propia, porque las moléculas que los forman se desplazan en todas direcciones y a gran velocidad; por esta razón los gases ocupan grandes espacios. El olor a comida que se prepara en la cocina se esparce por toda la casa con rapidez, porque las moléculas tienden a ocupar todo el espacio disponible.
¿Por qué los gases pueden comprimirse?
Los gases pueden comprimirse debido a la disposición separada de las moléculas que los compone. Si aplicas una fuerza intensa al émbolo de una jeringa con aire y tapas con el dedo su extremo anterior, notarás que el espacio ocupado por el gas disminuye. Esto se debe a que las moléculas se acercan entre sí y ocupan un menor espacio, el cual depende de la magnitud de la fuerza aplicada.
Los Gases > No tienen forma propia > Pueden comprimirse
___________________________________________