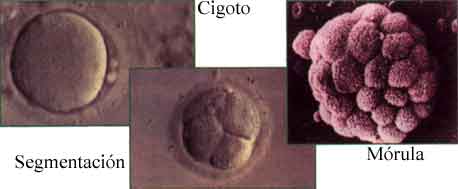
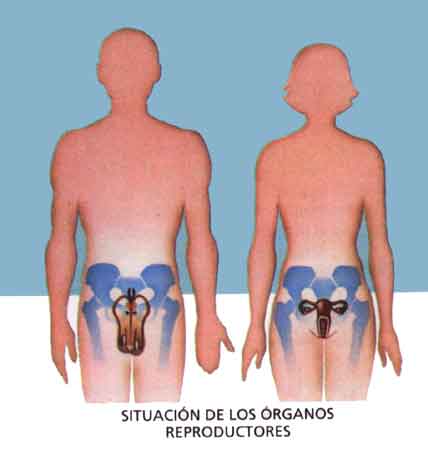
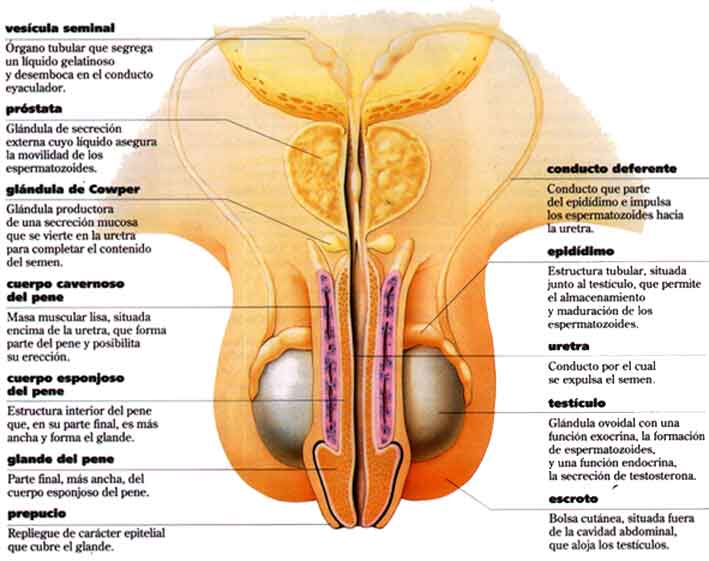
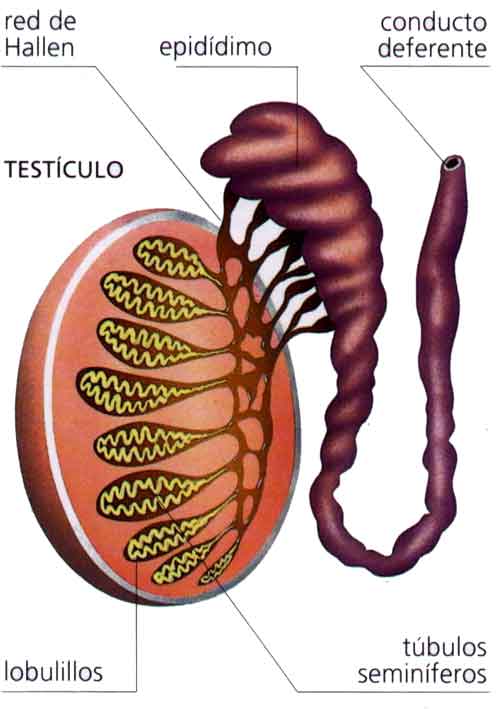
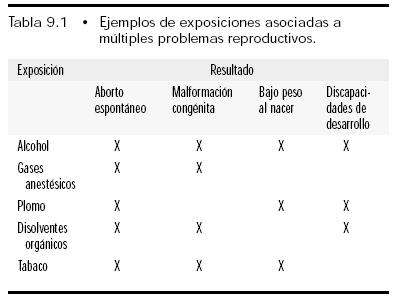
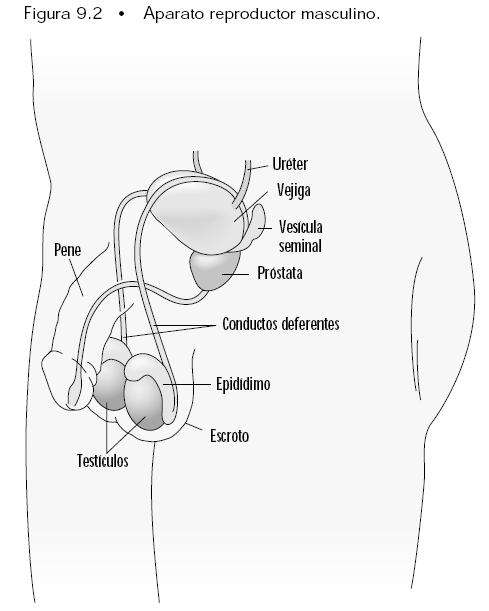
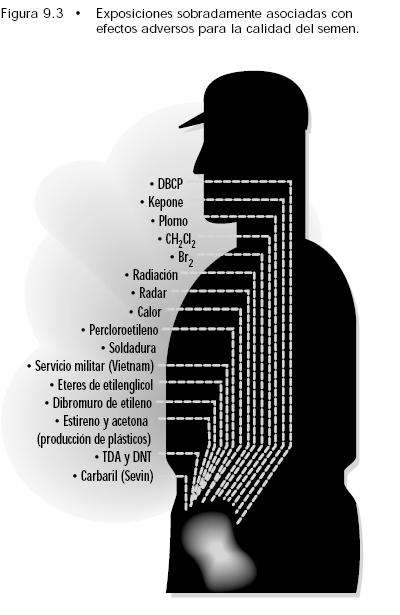
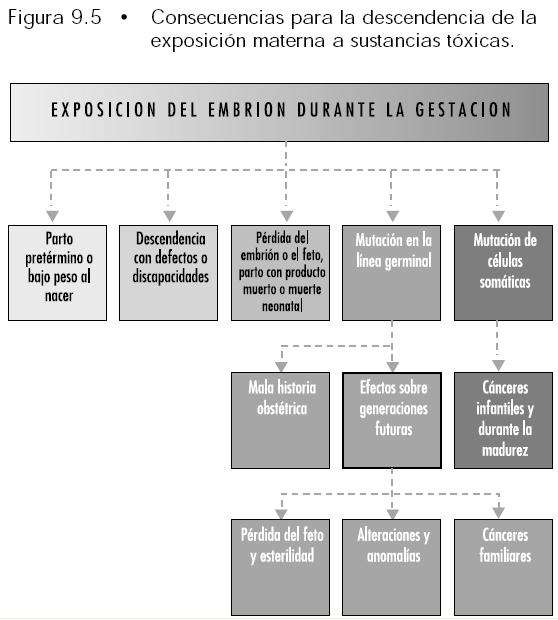
Continuamos...
ENCICLOPEDIA DE SALUD Y SEGURIDAD EN EL TRABAJO
SISTEMA REPRODUCTOR
Toxicidad reproductiva V.-
_____________________________________________________
LA PROTECCION DE LA MATERNIDAD EN LA LEGISLACION
Marie-Claire SéguretLa exposición a ciertos peligros para la salud y la seguridad en el
trabajo o en el entorno laboral puede tener, durante el embarazo,
efectos perjudiciales para la trabajadora y para su hijo no nacido.
La mujer necesita también, antes y después de dar a luz, un
período razonable de tiempo libre de trabajo para recuperarse,
alimentar a su hijo y establecer con él lazos afectivos. Muchas
mujeres necesitan y desean volver a su trabajo tras el nacimiento
de su hijo, lo que va siendo progresivamente reconocido como un
derecho fundamental, en un mundo en el que la tasa de actividad
de la mujer crece continuamente y se aproxima ya, en muchos
países, a la del hombre. El mantenimiento de los ingresos de las
mujeres durante la maternidad es vital, dado que la mayoría de
ellas han de contribuir al sostenimiento económico propio y de su
familia.
A lo largo del tiempo, los Estados han promulgado distintas
medidas para proteger a la mujer trabajadora durante el embarazo
y en el nacimiento de su hijo. Una característica de las
medidas más recientes es la prohibición de la discriminación en
el empleo por razón de embarazo. Otra tendencia actual es la de
permitir a los padres y madres compartir el permiso de paternidad
y maternidad tras el nacimiento, de manera que cualquiera
de ellos pueda ocuparse del niño. En muchos países, los
convenios colectivos contribuyen a la mejora y a la aplicación
más efectiva de estas medidas. Las empresas desempeñan
también un papel importante en la ampliación de la protección
a la maternidad, a través de las cláusulas de los contratos individuales
de trabajo y las políticas de empresa.
Los límites de la protecciónLas normas reguladoras de la protección a la mujer trabajadora
están normalmente restringidas al sector formal de la economía,
que en algunos casos representa sólo una pequeña parte de ésta,
no siendo de aplicación a las trabajadoras de actividades no registradas
de la economía informal o “sumergida”, que en muchos
países son la mayoría. Persiste así, dentro de la tendencia mundial
a mejorar y ampliar la protección a la maternidad, un reto
importante: dar cobertura a un extenso sector de la población
que vive y trabaja fuera de la economía formal.
En muchos países, la legislación laboral otorga protección a la
maternidad para las mujeres que trabajan en empresas, sean
industriales o no, del sector privado y, también a menudo, del
sector público, pero excluye con frecuencia a las que trabajan en
el hogar, a las empleadas domésticas y a las que lo hacen por
cuenta propia o en empresas que utilizan sólo a miembros de
una misma familia. Es importante la exclusión, bastante
frecuente, de las empresas con una plantilla inferior a un cierto
número de trabajadores (por ejemplo, en la República de Corea,
cinco empleados fijos), ya que son muchas las mujeres que
trabajan en pequeñas empresas.
En varios países, muchas mujeres con trabajos precarios,
como los empleos temporales o eventuales en Irlanda, están
excluidas de la legislación social, como también las trabajadoras
a tiempo parcial, según el número de horas de trabajo, o, en
ciertos casos, las que ocupan puestos directivos (por ejemplo, en
Singapur o Suiza), las que tienen una remuneración superior a
un determinado máximo (por ejemplo, en Mauricio) o las que
cobran según el rendimiento (por ejemplo, en Filipinas). En
algunos casos, poco frecuentes, no se concede permiso por
maternidad a las mujeres solteras (por ejemplo, a las profesoras,
en Trinidad y Tabago), mientras que en Australia (federal) se
concede ese permiso a las trabajadoras y a sus cónyuges, incluyendo
en este término a las parejas de hecho. Cuando se establecen
límites de edad (por ejemplo, en Israel, para las mujeres
menores de 18 años), no suelen resultar excluidas demasiadas
mujeres, ya que estos límites se fijan en torno al inicio de la edad
fértil.
Los empleados públicos disfrutan a menudo de regímenes
especiales, que les otorgan, a veces, condiciones más favorables
que las del sector privado, como, por ejemplo, permisos de
maternidad más largos, prestaciones en metálico por el importe
del salario completo y no de un porcentaje de éste, permisos de
paternidad más frecuentes o derechos de reincorporación al
puesto de trabajo más claramente establecidos. En muchos
países, estas buenas condiciones de los empleados públicos son
un factor de progreso, ya que los convenios colectivos del sector
privado suelen negociarse por referencia a sus normas de protección
de la maternidad.
De manera similar a la legislación laboral, aunque de forma
aún más restrictiva, las normas de seguridad social limitan, en
ocasiones, su aplicación a determinados sectores o categorías de
trabajadores, aun cuando pueden también permitir el acceso a
las prestaciones en metálico por maternidad a grupos sociales no
cubiertos por aquélla, como las mujeres que trabajan en régimen
autónomo o para sus maridos incluidos en este régimen. En
muchos países en vías de desarrollo, la legislación de seguridad
social se extiende sólo a un número limitado de sectores, debido
a la falta de recursos del Estado.
En las últimas décadas, la cobertura de la legislación se ha
extendido a un mayor número de sectores económicos y de categorías
de trabajadores, aunque, pese a esta cobertura, el disfrute
de ciertas ventajas, especialmente los permisos de maternidad y
las prestaciones en metálico, pueden depender de ciertos requisitos
de aplicabilidad, lo que determina que, a pesar de que la
mayoría de los países protejan la maternidad, las mujeres trabajadoras
no disfruten un derecho universal a esta protección.
El permiso por maternidadEl tiempo de descanso por parto varía entre unas pocas semanas
y varios meses, dividido a menudo en dos partes, antes y después
del nacimiento del hijo. En algunos países, se establece dentro de
este período un plazo en el que se prohíbe el trabajo, para garantizar
que la mujer disfrute un descanso suficiente. El período de
permiso se amplía normalmente en los casos de enfermedad,
parto prematuro o tardío y nacimientos múltiples, y se reduce en
caso de aborto espontáneo, alumbramiento de un feto muerto o
fallecimiento del niño.
La duración normal del permisoEl Convenio OIT relativo a la protección de la maternidad 1919
(nº 3), establecía que “no se permitirá el trabajo de la mujer
durante las seis semanas siguientes al parto; (y) tendrá derecho a
dejar de trabajar si aporta un certificado médico en el que se
declare que el parto tendrá probablemente lugar dentro de las
seis semanas siguientes”. El Convenio OIT relativo a la protección
de la maternidad (revisado), 1952 (nº 103), confirma el
permiso de 12 semanas, incluyendo la prohibición de trabajo en
las seis semanas siguientes al parto, pero no determina de modo
imperativo la utilización de las seis semanas restantes. La Recomendación
sobre la protección de la maternidad, 1952 (nº 95),
propone un permiso de 14 semanas. La mayor parte de los países
estudiados cumplen el criterio de las doce semanas, y al menos un
tercio garantiza un período aún más largo.
En varios países se permite elegir la distribución del permiso
de maternidad. En algunos de ellos, la ley no prescribe su distribución
(por ejemplo, en Tailandia) y las mujeres tienen derecho
a iniciarlo cuando lo deseen, mientras que en otros se establece
el número de días que deben tomarse tras el parto, pudiéndose
disponer del resto antes o después de éste.
Otros países no permiten ninguna flexibilidad: la ley establece
dos períodos de descanso, antes y después del parto, que pueden
ser iguales, especialmente cuando el tiempo total de descanso es
relativamente corto. Cuando éste excede de 12 semanas, el
período prenatal es a menudo más corto que el posnatal
(por ejemplo, en Alemania, seis semanas antes y ocho semanas
después del parto).
En un número relativamente pequeño de países (por ejemplo,
Benin, Chile o Italia) está prohibido el empleo de las mujeres
durante todo el período de permiso por maternidad. En otros, se
establece un tiempo obligatorio de permiso, a menudo después
del parto, normalmente de seis semanas (por ejemplo, Barbados,
Irlanda, India o Marruecos). El número de países que establecen
algún plazo imperativo de permiso antes del parto ha aumentado
en la última década. En algunos países, por el contrario, no
hay período de permiso obligatorio (por ejemplo, en Canadá),
por considerarse que el permiso es un derecho que debe ejercitarse
libremente y que el tiempo concedido debe disponerse del
modo que mejor convenga a los intereses y necesidades personales
de cada mujer.
Los requisitos para disfrutar del permiso por maternidadLa legislación de la mayoría de los países reconoce el derecho de
la mujer a disfrutar de un permiso por maternidad mediante el
establecimiento de su período de duración, de modo que basta
con que una mujer se encuentre trabajando en el momento del
inicio del permiso para tener derecho a ello. Sin embargo, en
cierto número de países se exige que la mujer haya trabajado
durante un plazo mínimo antes de la fecha de libranza, plazo que
va desde las 13 semanas, en Ontario o Irlanda, a los dos años, en
Zambia.
En varios países, se exige que la mujer haya trabajado un
determinado número de horas semanales o mensuales para
tener derecho al permiso y a otras prestaciones por maternidad,
lo que puede dar lugar, cuando el umbral que se fija es alto
(como las 35 horas semanales requeridas en Malta), a la exclusión
de un gran número de mujeres, que representan la mayoría
de los trabajadores a tiempo parcial. En algunos casos, estos
umbrales se han reducido recientemente (por ejemplo, en
Irlanda, de 16 a ocho horas semanales).
Un pequeño grupo de países limita el número de veces que
una mujer puede solicitar el permiso por maternidad dentro de
un determinado período (por ejemplo, dos años), o mientras
trabaja para una misma empresa, o aun a lo largo de toda la
vida de la trabajadora (por ejemplo, en Egipto o Malasia). En
Zimbabwe, por ejemplo, pueden beneficiarse del permiso una
vez cada 24 meses, hasta un máximo de tres veces, mientras
trabajen para una misma empresa. En otros países, no se limita
el número de permisos, pero sí las prestaciones en metálico
(por ejemplo, en Tailandia), o bien se conceden permisos de una
duración menor con prestaciones (por ejemplo, en Sri Lanka,
12 semanas para los primeros dos hijos y seis para el tercero y
restantes). Parece estar aumentando el número de países que
limitan el derecho a los permisos y prestaciones por maternidad
a un cierto número de embarazos, de hijos nacidos o de hijos
supervivientes (entre dos y cuatro), aunque no está claro en absoluto
que la duración del permiso sea un factor decisivo en las
decisiones de los padres sobre el tamaño de la familia.
El preaviso a la empresaEn la mayoría de los países, el único requisito para la concesión
del permiso por maternidad es la presentación de un certificado
médico, pero, en algunos casos, se exige también notificar con
anterioridad a la empresa el propósito de tomar el permiso. El
plazo de preaviso varía desde el momento del conocimiento del
embarazo (por ejemplo, en Alemania), hasta una semana antes de
iniciar el permiso (por ejemplo, en Bélgica), y su falta puede
determinar la pérdida del derecho, como en Irlanda, donde la
notificación debe realizarse tan pronto como sea razonablemente
posible, pero en ningún caso después de las cuatro semanas
previas al comienzo del permiso. En Canadá (federal), la mujer
puede eximirse por causa justificada del requisito del preaviso,
cuyo plazo, a nivel provincial, varía entre cuatro meses y dos
semanas. En Manitoba, la mujer conserva su derecho al permiso
aunque no cumpla este requisito, mientras que en la mayoría de
las restantes provincias se reduce, en este caso, la duración del
permiso (a seis semanas normalmente, frente a las 17 ó 18
semanas ordinarias) y en algunos otros países no se establecen
con claridad las consecuencias de la falta de preaviso.
Las prestaciones en metálicoLa mayoría de las mujeres no pueden permitirse dejar de percibir
sus ingresos durante el permiso por maternidad y, si tuvieran que
hacerlo, renunciarían a una parte de este período. Dado que el
nacimiento de niños sanos beneficia al conjunto de la nación, las
empresas no deberían, por razones de equidad, soportar la totalidad
del coste generado por la ausencia de sus trabajadoras.
Desde 1919, la OIT ha propugnado la concesión de prestaciones
en metálico durante el permiso por maternidad, con cargo a
fondos públicos o mediante un sistema de seguro. El Convenio
nº 103 exige que las contribuciones de los sistemas obligatorios de
seguridad social se sufraguen en relación con el número total de
hombres y mujeres empleados en la empresa, sin distinciones por
razón de sexo. Aunque en unos pocos países las prestaciones por
maternidad constituyen sólo un porcentaje relativamente
pequeño del salario, la proporción de los dos tercios propuesta en
el Convenio nº 103 se alcanza en varios y se supera en muchos
otros. En más de la mitad de los países investigados, las prestaciones
por maternidad suponen la totalidad del salario mínimo o
del salario completo.
Muchas legislaciones de seguridad social prevén una prestación
específica por maternidad, reconociéndola en sí misma
como una contingencia independiente, mientras que otras
aplican a este caso prestaciones de enfermedad o desempleo.
Esta asimilación de la maternidad a una incapacidad, o del
permiso a una situación de desempleo, podría considerarse un
trato discriminatorio, ya que, por lo general, tales prestaciones
sólo se conceden por un período determinado, y la mujer que las
utiliza por razón de su maternidad puede encontrarse en el
futuro sin cobertura suficiente para una auténtica enfermedad o
una situación de desempleo real. Cuando se elaboró la Directiva
del Consejo Europeo (1992), hubo una fuerte oposición a la
propuesta de conceder prestaciones de enfermedad durante el
permiso por maternidad, por considerarse que la igualdad de
trato entre hombres y mujeres exigía reconocer la maternidad
como causa independiente de prestaciones. Como solución transaccional,
se ha definido la prestación económica por maternidad
como un ingreso garantizado equivalente al que la
trabajadora en cuestión recibiría en caso de enfermedad.
En casi 80 países estudiados, las prestaciones se pagan por los
sistemas nacionales de seguridad social, quedando, en más de
otros 40, a cargo de la empresa, y repartiéndose, en alrededor de
15 países, entre ésta y la seguridad social, ya sea al cincuenta por
ciento (por ejemplo, en Costa Rica) o en otras proporciones
(por ejemplo, en Honduras: dos tercios a cargo de la seguridad
social y un tercio a cargo de la empresa). En otros casos, cuando
el importe cubierto por la seguridad social está basado en unos
ingresos legalmente garantizados que representan una pequeña
parte del salario total de la mujer, se impone a la empresa el
pago del resto (por ejemplo, en Burkina Faso). En muchos convenios
colectivos y contratos individuales de trabajo se contempla
también de forma voluntaria el pago de cantidades adicionales
por la empresa. La participación de ésta en el pago de las prestaciones
en metálico por maternidad puede ser una solución
realista para el problema de la carencia de otras fuentes de
financiación.
La protección de la salud de la mujer embarazada y lactanteEn la línea marcada por la Recomendación sobre la protección
de la salud de la maternidad, 1952 (nº 95), muchos países prevén
medidas para la protección de la mujer embarazada y su hijo,
dirigidas a reducir los esfuerzos que ha de realizar, mediante la
adaptación de los horarios de trabajo o a protegerla frente a
trabajos peligrosos o perjudiciales para la salud.
En unos pocos países (por ejemplo, los Países Bajos o Panamá)
se especifica legalmente la obligación de la empresa de organizar
el trabajo de modo que no afecte al buen desarrollo del
embarazo. Este enfoque, propio del tratamiento moderno de la
salud y seguridad en el trabajo, es el más satisfactorio, porque
permite adaptar a las necesidades de cada mujer las correspondientes
medidas preventivas. Pero lo más frecuente es la protección
vía prohibición o limitación del trabajo perjudicial para la
salud de la madre o el hijo, establecida en términos generales o
sólo para ciertos tipos de trabajos peligrosos. En México, la
prohibición no se aplica si se adoptan, a juicio de la autoridad
competente, las medidas de protección necesarias, ni tampoco
en el caso de las mujeres que ocupan puestos directivos o que
poseen un título universitario, una diplomatura técnica o los
conocimientos y experiencia necesarios para proseguir su
trabajo.
En muchos países se prohíbe legalmente que la mujer embarazada
o en período de lactancia realice trabajos “superiores a
sus fuerzas”, “que supongan peligro”, “que sean peligrosos para
su salud o la de su hijo” o “que exijan un esfuerzo físico inadecuado
para su estado”. Este tipo de prohibición genérica puede
implicar problemas de aplicación: ¿quién y cómo debe determinar
si un determinado trabajo está por encima de las fuerzas
de una persona: el trabajador afectado, la empresa, el inspector
de trabajo, el médico especialista en salud en el trabajo o el
médico personal de la mujer? Las diferencias de apreciación
pueden conducir a que una mujer sea apartada de un trabajo
que, de hecho, sí podría realizar, manteniendo, en cambio, a
otra en un trabajo excesivamente gravoso.
En otros países se establecen listas, a veces muy detalladas, de
los tipos de trabajos prohibidos para las mujeres embarazadas o
lactantes (por ejemplo, en Austria o Alemania). Suele incluirse el
manejo de objetos pesados; en algunos casos se prohíbe expresamente
la exposición a ciertas sustancias químicas (como el
benceno), los agentes biológicos, el plomo o la radiación; en
Japón se prohíbe el trabajo subterráneo durante el embarazo y
el primer año posterior al parto; en Alemania, el trabajo a
destajo y en líneas de montaje de ritmo fijo; en unos pocos
países, no se permite asignar trabajos a las embarazadas fuera de
su lugar de residencia estable (por ejemplo, en Ghana, después
del cuarto mes); en Austria, está prohibido fumar en los lugares
de trabajo con mujeres embarazadas.
En varios países (por ejemplo, Angola, Bulgaria, Haití o
Alemania), se exige a la empresa trasladar a la embarazada a un
puesto de trabajo adecuado, garantizándose, en muchos casos, el
mantenimiento del salario anterior aunque el correspondiente al
nuevo puesto sea inferior, garantía que, en la República Democrática
Popular Lao, se concede sólo durante un período de tres
meses, y, en la Federación de Rusia, se extiende también al
período de búsqueda de este nuevo puesto; en algunos países
(por ejemplo, en Rumania), la seguridad social cubre la diferencia
entre estos dos salarios, lo que es preferible, dado que el
coste de la protección de la maternidad no debe, en la medida
de lo posible, ser soportado por la empresa afectada.
También puede preverse el traslado en el caso de trabajos no
peligrosos en sí mismos, cuando un médico certifica que resulta
perjudicial para el estado de salud de una mujer determinada
(por ejemplo, en Francia), o a petición del propio trabajador (por
ejemplo, en Suiza o Canadá). En algunos casos, se faculta legalmente
a la empresa para proponer el traslado, recurriéndose, en
caso de desacuerdo del trabajador, a la decisión de un médico
del trabajo con respecto a la necesidad médica del cambio y a la
capacidad física de la mujer para realizar el nuevo trabajo
propuesto.
En un reducido número de países, se especifica que la transferencia
tiene carácter temporal y que la trabajadora ha de ser
reasignada a su trabajo anterior al término de su permiso por
maternidad o de un determinado plazo posterior (por ejemplo,
en Francia). Cuando no es posible el traslado, algunos países
establecen que se habrá de conceder un permiso de enfermedad
(por ejemplo, en Seychelles), o, como se ha analizado anteriormente,
que se anticipará el comienzo del permiso por maternidad
(por ejemplo, en Islandia).
La no discriminaciónEn un número cada vez mayor de países se han adoptado
medidas para garantizar que la mujer no sufra discriminación
por razón de su embarazo, con objeto de asegurar que reciba un
trato igual al de los hombres y al de las demás mujeres en el
acceso al empleo y durante su trabajo, y, especialmente, que no
sea relegada, pierda su antigüedad o se le deniegue un ascenso
por la mera causa de su gestación. Hoy es cada vez más habitual
que las legislaciones nacionales prohíban la discriminación por
razón de sexo, lo que puede interpretarse por los tribunales,
como se ha hecho ya en muchos casos, como una prohibición de
la discriminación por razón de embarazo. Este ha sido el enfoque
seguido por el Tribunal de Justicia de las Comunidades Europeas,
que, en una sentencia de 1989, resolvió que una empresa que
despide o se niega a contratar a una mujer por estar embarazada
infringe la Directiva 76/207/CEE del Consejo Europeo sobre
igualdad de trato. La importancia de esta sentencia radica en que
establece con claridad que existe discriminación por razón de
sexo cuando se adoptan decisiones relativas al empleo por razón
de embarazo, aunque las leyes no citen de manera específica esta
circunstancia entre las causas prohibidas de discriminación. Es
habitual, en los juicios por discriminación sexual, comparar el
trato recibido por la mujer con el equivalente para un hipotético
hombre. Pues bien, el Tribunal resolvió que esta comparación no
es procedente en el caso de la mujer embarazada, ya que la gestación
es una circunstancia exclusiva de la mujer, por lo que el trato
desfavorable por esta causa es, por definición, un caso de discriminación
por razón de sexo. Esta interpretación coincide con la
postura de la Comisión de Expertos de la OIT para la Aplicación
de Convenios y Recomendaciones respecto al alcance del
Convenio sobre la discriminación (empleo y ocupación), 1958
(nº 111), que señala el carácter discriminatorio de las distinciones
por razón de embarazo, parto y circunstancias médicas derivadas
(OIT 1988).
Varios países han establecido prohibiciones explícitas de la
discriminación por causa de embarazo (por ejemplo, Australia,
Italia, Estados Unidos, Venezuela), mientras que otros (por
ejemplo, Finlandia) definen la discriminación por razón de sexo
en términos que incluyen la que se basa en la gestación o en la
ausencia por permiso de maternidad. En Estados Unidos se
garantiza la protección al equiparar el embarazo a una discapacidad:
en las empresas con más de 15 trabajadores se prohíbe la
discriminación de la mujer por causa de embarazo, parto o
problemas médicos derivados, y las políticas y prácticas relativas
a la gestación y otros aspectos relacionados han de aplicarse
en los mismos términos y condiciones que a las demás
discapacidades.
Las legislaciones de varios países contienen normas específicas
que señalan casos de discriminación por embarazo. En la Federación
de Rusia, por ejemplo, las empresas no pueden negarse a
contratar a una mujer por razón de su embarazo y, si lo hacen,
deben manifestar por escrito las razones por las que no se la
contrata. En Francia, es ilegal tener en cuenta la gestación para
negar un empleo a una mujer, resolver su contrato durante el
período de prueba o trasladarla, así como tratar de averiguar si
una candidata a un puesto está embarazada, o pedir a la mujer
que lo revele, sea al solicitar un nuevo empleo o estando ya
empleada, excepto en el caso de que ésta solicite la aplicación de
alguna de las ventajas legales o reglamentarias de protección de
la mujer embarazada.
La imposición unilateral y arbitraria del traslado a otro puesto
de trabajo de una gestante puede suponer una discriminación,
como es el caso en Bolivia y otros países de la región, donde esta
protección se extiende además durante un año tras el nacimiento
del hijo.
La combinación del derecho de la mujer trabajadora a la
protección de su salud durante el embarazo y de su derecho a no
ser objeto de discriminación resulta particularmente complicada
en el momento de su contratación. ¿Debe la mujer embarazada
revelar su estado, especialmente cuando se presenta para un
puesto que implica trabajos prohibidos para gestantes? El
Tribunal Federal de Trabajo de Alemania sostuvo, en una
sentencia de 1988, que la mujer embarazada que concurre a un
puesto de trabajo exclusivamente nocturno, prohibido para
gestantes por la legislación alemana, debe informar de su estado
a la empresa potencialmente contratante. Esta sentencia fue
revocada por el Tribunal de Justicia de las Comunidades Europeas
como contraria a la Directiva CEE sobre igualdad de trato,
de 1976. El Tribunal consideró que la Directiva no permite
sostener la nulidad de un contrato por razón de la prohibición
legal del trabajo nocturno, ni su resolución por parte de la
empresa alegando el error de cualquiera de las partes con
respecto a una característica personal esencial de la mujer en el
momento de su celebración, ya que, al no haberse otorgado el
contrato por tiempo determinado, y siendo sólo temporal la
discapacidad por embarazo de la empleada para realizar el
trabajo para el que fue contratada, tal interpretación sería
contraria a los objetivos de la Directiva.
Estabilidad del empleoSon muchas las mujeres que han perdido su empleo a causa del
embarazo. La estabilidad del empleo es en la actualidad, pese a la
variedad de las disposiciones en vigor, un aspecto muy importante
de las políticas de protección de la maternidad.
Las normas laborales internacionales abordan el tema de dos
maneras distintas. Los convenios sobre protección de la maternidad
prohíben el despido durante dicho permiso por maternidad
o su prolongación, en los términos previstos en el artículo
4 del Convenio nº 3 y el artículo 6 del Convenio nº 103, o
cuando el plazo establecido en la notificación de despido expire
durante el permiso. No está permitido el despido por causas de
otro modo lícitas durante este período (OIT 1965). En el caso de
que una mujer sea despedida antes de tomar su permiso de
maternidad, deberá suspenderse la notificación durante su
ausencia y continuar a su vuelta. La Recomendación sobre la
protección de la maternidad, 1952 (nº 95) reclama la protección
del empleo de la mujer embarazada a partir del día en que a la
empresa le haya sido notificado el embarazo y hasta un mes
después de la terminación del período de permiso por maternidad,
y considera como causas justas de despido en este período
la comisión de una falta grave por la mujer empleada, la cesación
de las actividades de la empresa y la terminación del
contrato de trabajo temporal. En las letras d) y e) del artículo 5
del Convenio sobre la terminación de la relación de trabajo,
1982 (nº 158), no se prohíbe el despido, pero se establece
que el embarazo o la ausencia del trabajo durante el
permiso por maternidad no constituirá causa justificada para
esta terminación.
En la Unión Europea, la Directiva de 1992 prohíbe el despido
desde el comienzo del embarazo hasta el final del permiso por
maternidad, excepto en casos excepcionales no relacionados con
el estado de la trabajadora.
La mayoría de los países disponen dos grupos de normas con
respecto al despido. En casos como los de cierre de la empresa,
exceso de mano de obra o incapacidad del trabajador, por
diversas razones, para realizar la tarea para la que fue contratado
o para hacerlo a satisfacción de la empresa, se aplica el
despido con preaviso. Cuando el trabajador es culpable de negligencia,
mala conducta u otras faltas de comportamiento graves,
normalmente previstas de modo exhaustivo en la legislación, se
aplica el despido sin preaviso.
En los casos de despido con preaviso, resulta claro que la
empresa podría decidir de manera arbitraria que el embarazo es
incompatible con las tareas de la trabajadora y despedirla por
razón de su gestación. Si quisiera eludir sus obligaciones con
respecto a las mujeres embarazadas, o simplemente evitar su
presencia en el lugar de trabajo, podría buscar un pretexto para
despedirlas sin recurrir, para esquivar las normas antidiscriminatorias,
al embarazo como causa del despido. Son muchos los que
coinciden en que es legítimo proteger a las trabajadoras frente a
estas decisiones discriminatorias: en gran número de países se
aplica, como principio de equidad, la prohibición del despido
con preaviso por razón de embarazo durante la gestación y
durante el permiso por maternidad.
La Comisión de Expertos para la Aplicación de Convenios y
Recomendaciones de la OIT considera que la prohibición del
despido durante el permiso por maternidad no impide a la
empresa dar por terminada una relación de trabajo cuando
comprueba una falta grave de una trabajadora, sino que cuando
hay, como en este caso, razones justificadas, está obligada a
ampliar el plazo legal de preaviso hasta completar el período de
protección previsto en los convenios. Esta situación se da, por
ejemplo, en Bélgica, donde puede efectuarse el preaviso de
modo que expire tras la vuelta de la mujer al trabajo.
La protección de la mujer embarazada frente al despido en
caso de cierre de la empresa o ajuste de plantilla por causas
económicas constituye también un problema. Para la empresa
que deja de operar, supone sin duda una carga continuar
pagando el sueldo de quien ya no trabaja para ella, aunque sea
por un corto período, pero las perspectivas de empleo son más
adversas para la mujer embarazada que para la que no lo está o
para el hombre, y aquélla necesita especialmente la estabilidad
económica y emocional que implica conservar el empleo, así
como posponer la búsqueda del nuevo trabajo hasta después del
parto. Por este motivo, en los países en que la legislación establece
un orden de despido para las distintas categorías de trabajadores
en casos de ajustes de plantilla, las mujeres embarazadas
se encuentran en el último o penúltimo grupo (por ejemplo, en
Etiopía).
Los permisos y prestaciones para el padre y para
ambos progenitores
Más allá de la protección de la salud y del estatuto laboral de la
mujer embarazada o lactante, muchos países establecen permisos
de paternidad (un corto período de permiso en el momento del
nacimiento o en torno a éste). Hay otros tipos de permisos en
función de las necesidades del niño, como el que se concede por
adopción o para la crianza del hijo. Este último se prevé en
muchos países, con distintos enfoques: un grupo de países establece
la libranza de la madre de niños muy pequeños (permiso
opcional por maternidad), mientras que otros contemplan
permisos adicionales para ambos padres (permiso conjunto de
paternidad y maternidad para la educación). Esta idea de que
tanto el padre como la madre han de estar disponibles para el
cuidado de los niños pequeños se plasma en estos permisos
conjuntos de paternidad y maternidad, que permiten un largo
período de descanso para ambos progenitores.
__________________________________________
Un artículo de gran actualidad....
__________________________________________________