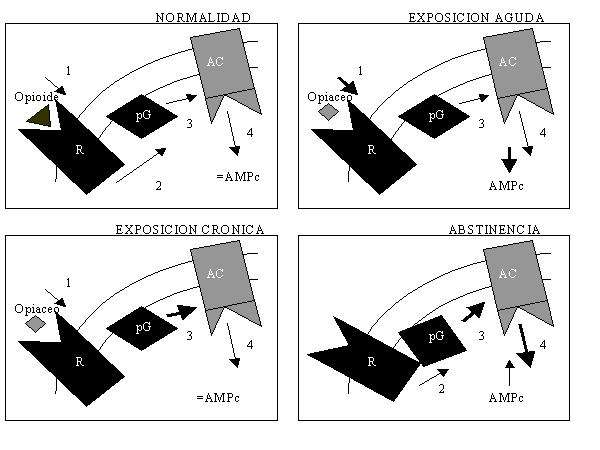
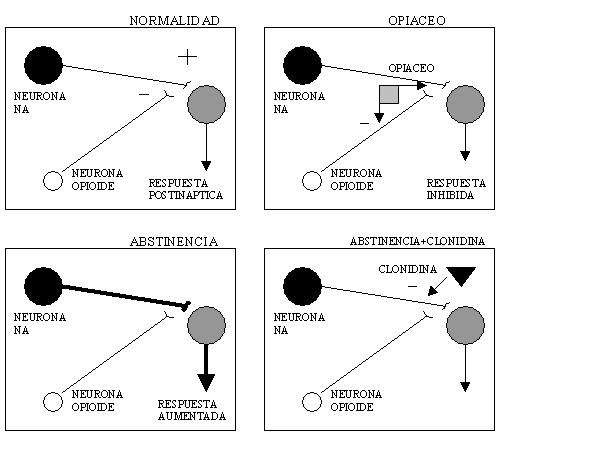
Completando, ampliando, resumiendo, definiendo, repitiendo conceptos...
________________________________________________________
Henry Gray (1821–1865). Anatomy of the Human Body. 1918
6. The Spinal Nerves
6c. The Thoracic Nerves
(NN. Thoracales)
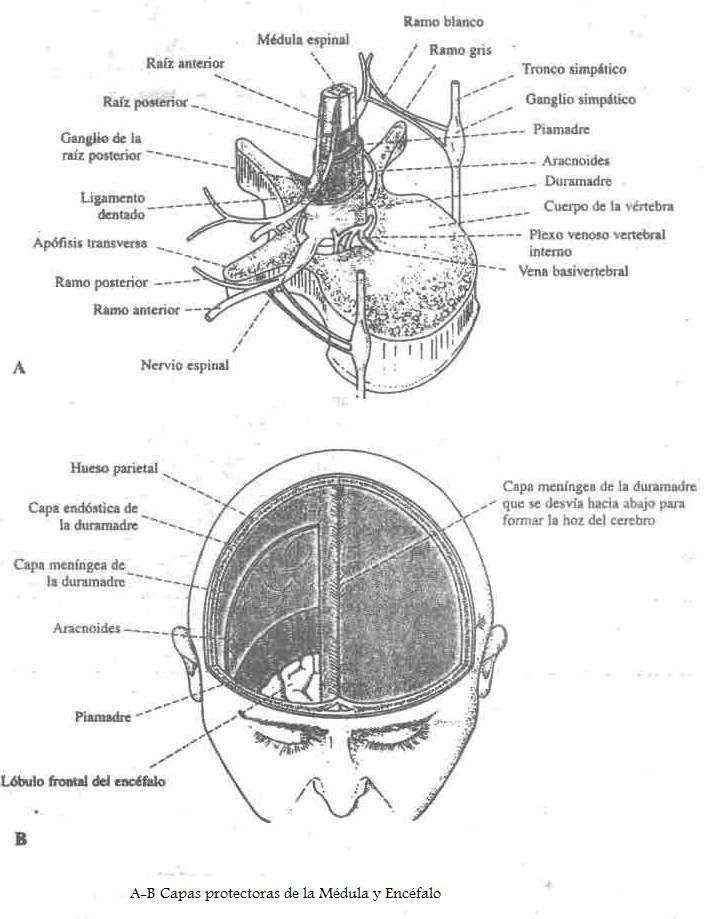
The anterior divisions of the thoracic nerves (rami anteriores; ventral divisions) are twelve in number on either side. Eleven of them are situated between the ribs, and are therefore termed intercostal; the twelfth lies below the last rib. Each nerve is connected with the adjoining ganglion of the sympathetic trunk by a gray and a white ramus communicans. The intercostal nerves are distributed chiefly to the parietes of the thorax and abdomen, and differ from the anterior divisions of the other spinal nerves, in that each pursues an independent course, i. e., there is no plexus formation. The first two nerves supply fibers to the upper limb in addition to their thoracic branches; the next four are limited in their distribution to the parietes of the thorax; the lower five supply the parietes of the thorax and abdomen. The twelfth thoracic is distributed to the abdominal wall and the skin of the buttock.

Diagram of the course and branches of a typica intercostal nerve.

Cutaneous distribution of thoracic nerves. (Testut.)

Intercostal nerves, the superficial muscles having been removed. (Testut).